
分享:常温碱性水溶液中联氨对20钢腐蚀行为的影响
联氨(N2H4)是一种强还原性物质,在火力发电过程中,常用作锅炉给水的辅助除氧剂[1]。近年来研究发现,联氨及其衍生物对碳钢有一定的缓蚀作用[2-3]。锅炉在停炉期间往往存在比运行时更严重的腐蚀,这主要是由于停炉期间大量空气进入锅炉内部,在O2和CO2等共同作用下,金属腐蚀加速。目前,电站锅炉的停炉保护主要通过阻止锅炉表面与水汽和氧气接触来实现,常用方法有充氮法、保持蒸汽压力法、烘干法、成膜胺保护法、气相缓蚀剂保护法、氨法保护等[4-7]。氨-联氨保护法是目前较为常用的湿法停炉保护法。其中氨水的主要作用是调节水的pH。水的pH可对碳钢的腐蚀行为产生重要影响,但在不同介质中pH对碳钢的腐蚀行为影响又有所差别[8-11]。常温下联氨的主要作用不再是除氧,而是通过吸附或促进金属表面的钝化来抑制腐蚀[12]。但联氨的毒性较大,不仅在使用时存在安全隐患,而且会对水环境造成严重威胁[13]。联氨的排放处理也是一个问题,其减量排放技术也得到了广泛关注[14-16]。改进氨-联氨处理工艺,在保证腐蚀控制效果的前提下不用或少用联氨,是目前电厂湿法停炉保护需要解决的重要问题之一。作者以20钢为研究对象,研究了其在不同pH的常温水溶液中的腐蚀行为,探讨联氨对碳钢腐蚀行为的影响,分析氨-联氨停用保护的改进方法。
1. 试验
试验材料为20钢,其主要化学成分(质量分数)为:0.20% C、0.18% Si、0.31% Mn、0.02% Cr、0.018% Ni、<0.035%P、<0.035% S、<0.25%Cu。将试验材料加工成尺寸为10 mm×10 mm×2 mm的电极试样,其工作面面积为10 mm×10 mm,在工作面的背面焊接铜导线,再用环氧树脂封装非工作面。使用400号至1200号金相砂纸逐级打磨工作面,再依次用乙醇、丙酮以及去离子水清洗。
试验溶液为氨水-联氨溶液,用电导率1.2 μS/cm的去离子水配制,向去离子水中加入不同量联氨,使其质量浓度分别为0、50、100、200 mg/L,通过加氨水调节溶液pH到设定值(9.5、10.0、10.5、11.0)。通氮气去除水中溶解氧,残余溶解氧质量浓度约为0.50 mg/L,试验温度为25 ℃。将工作电极浸入不同pH的试验溶液中密封浸泡72 h后,进行电化学测试和形貌观察。
电化学测试采用三电极体系,待测试样为工作电极,铂电极和饱和甘汞电极分别作辅助电极和参比电极。工作电极和参比电极之间用盐桥连接。电化学测试仪器为辰华CHI604E电化学工作站。电化学阻抗谱测量在开路电位下进行,频率范围为0.01 Hz~100 kHz。动电位极化曲线扫描速率为1.0 mV/s。
2. 结果与讨论
2.1 电化学阻抗谱
溶液的pH会直接影响碳钢的腐蚀行为[17]。在较低pH的酸性溶液中,碳钢可快速溶解生成Fe2+。而在碱性溶液中,碳钢腐蚀产物会转变为铁的氧化物,当氧化物致密覆盖在碳钢表面时,可阻止碳钢的进一步腐蚀,即发生钝化。但当pH过高时,腐蚀产物又会转变为可溶性的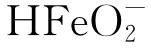 。图1为在不同联氨含量和不同pH的氨水-联氨溶液中浸泡72 h后20钢的电化学阻抗谱。
。图1为在不同联氨含量和不同pH的氨水-联氨溶液中浸泡72 h后20钢的电化学阻抗谱。
由图1可见,pH为9.5和10.0的氨水-联氨溶液的电导率较低,其对应的Nyquist图中出现了高频容抗弧,这应该对应于鲁金毛细管端与溶液之间接触区的电阻和电容,与电化学过程无关[18]。因此,作者未对阻抗谱进行拟合,而是直接采用0.01 Hz下的阻抗模|Z|0.01来分析电极的耐蚀性[19]。
图2为在不同联氨含量和不同pH的氨水-联氨溶液中20钢的|Z|0.01。|Z|0.01越小,说明耐蚀性越好。在不含联氨的溶液中,当pH为9.5和10.0时,20钢的|Z|0.01明显较低,分别为8.55 kΩ·cm2和6.78 kΩ·cm2;当pH提升到10.5时,|Z|0.01大幅提高到47.6 kΩ·cm2,表明20钢表面发生钝化;当pH继续提升到11.0时,|Z|0.01反而下降到约25.9 kΩ·cm2。这可能与溶液的电导率急剧增大有关(pH为9.5、10.0、10.5和11.0时溶液的电导率分别为11.8、29.5、78.3、231.0 μS/cm)。当溶液pH为9.5和10.0时,20钢的|Z|0.01都随着联氨含量的增加而不断增大,其中pH为10.0时,|Z|0.01的增幅明显较小。当溶液pH升高到10.5和11.0时,20钢的|Z|0.01随着联氨含量的增加而减小,说明联胺的加入反而使20钢的耐蚀性下降,但pH为11.0时20钢的|Z|0.01均小于pH为10.5时。
上述结果显示,在不同pH的溶液中,联氨对20钢的腐蚀行为产生了两种截然不同的作用。在pH为9.5和10.0的溶液中,联氨表现出缓蚀作用;而在pH为10.5和11.0的溶液中,联氨对20钢腐蚀表现出明显的促进作用。下面将结合极化曲线来分析联氨在不同pH溶液中对20钢腐蚀产生上述不同影响的原因。
2.2 极化曲线
图3为在不同pH和不同联氨含量的氨水-联氨溶液中20钢的动电位极化曲线。根据图3获得腐蚀电流密度与pH的关系,见图4。
由图3可见,在pH为9.5和10.0的溶液中,联氨的加入使20钢的自腐蚀电位正移,而腐蚀电流密度减小,说明联氨主要抑制了20钢的阳极溶解过程;且在相同pH条件下,联氨含量越大,自腐蚀电位越正,而腐蚀电流密度越小,这显示联氨的阳极抑制作用越强。比较pH为9.5和10.0的溶液中20钢的腐蚀行为可以发现,在pH为9.5的溶液中联氨对20钢的腐蚀抑制作用更强,表明pH的增大使联氨的缓蚀作用减弱。而在pH为10.5和11.0的溶液中,联氨的加入使20钢的自腐蚀电位负移,腐蚀电流密度增大,说明在此pH条件下联氨促进了碳钢的阳极溶解过程;且在相同pH条件下,联氨含量越大,自腐蚀电位越负、腐蚀电流密度越大。比较pH为10.5和11.0的溶液中20钢的腐蚀行为可以发现,在pH为10.5的溶液中联氨对20钢的腐蚀促进作用更小。
2.3 讨论
通常认为联氨的缓蚀作用主要体现在以下几个方面:
(1)除氧作用 溶解氧是常见的阴极去极化剂,而联氨具有较强的还原性,可以与水溶液中的溶解氧分子反应生成氮气和水,从而降低水中的溶解氧含量,抑制氧的阴极去极化过程,使金属的腐蚀速率降低[13,20]。但一般认为,常温下联氨与氧气的反应速率很小[21-22]。
(2)钝化作用 联氨可以将碳钢表面疏松的腐蚀产物Fe2O3还原为致密的Fe3O4氧化物膜,使碳钢表面发生钝化而降低其腐蚀速率[12]。
(3)吸附作用 不少观点认为联氨可以优先吸附在碳钢表面的阳极区域,增大碳钢的阳极溶解阻力,使其自腐蚀电位正移并降低其腐蚀速率[23-24]。
(4)替代阳极反应 水溶液中的联氨可以起到类似于牺牲阳极的作用,通过与水中的OH-反应生成水和游离电子,保护铁不被溶解。
从电化学测试结果可知,在不同的pH溶液中联氨对20钢的腐蚀具有完全相反的效果。当溶液pH较低时(pH为9.5和10.0),联氨抑制了20钢的腐蚀;而当溶液pH较高时(pH为10.5和11.0),联氨促进了20钢的腐蚀。从对腐蚀的抑制作用来看,联氨在降低20钢腐蚀电流密度的同时,使20钢的自腐蚀电位正移。如果联氨的缓蚀作用是由于其对溶解氧的去除,则溶解氧含量的降低将增大腐蚀体系中的阴极极化作用,使金属的自腐蚀电位降低、腐蚀电流密度减小。因此,这里联氨的缓蚀作用应该不是由联氨的除氧作用引起的。否则在联氨含量较高的情况下,其应该表现出更好的除氧效果。在本试验的碱性环境中,20钢本身就会产生钝化现象,表面形成致密钝化膜,因此不存在可以供联氨还原的Fe2O3,也就不可能发生钝化反应。这也是未加入联氨时20钢在pH 10.5的溶液中仍然具有较低腐蚀电流密度的原因。
因此,常温下在pH为9.5和10.0的水溶液中,联氨对20钢的缓蚀作用应该是缘于其在阳极区域的吸附作用,以及其在阳极表面发生替代阳极的氧化反应。该反应的发生对20钢起到了类似于牺牲阳极的保护作用,抑制了铁阳极的溶解,同时联氨在阳极表面的吸附进一步降低了20钢的腐蚀速率。而在pH为10.5和11.0的水溶液中,加入联氨后20钢的钝化性能下降。联氨的吸附阻碍了氧气分子在20钢表面的吸附,抑制了钝化膜的形成,但同时已经形成的部分钝化膜又阻止了联氨的吸附,二者互相影响,使20钢表面无法生成致密保护膜,从而使20钢的腐蚀加速,所以在pH较高的水溶液中,联氨的存在可能反而使20钢的耐蚀性下降。
3. 结论
(1)在不含联氨的氨水溶液中,当pH不高于10.0时,20钢电极处于活性溶解状态,当pH达到10.5时,20钢电极发生了钝化。
(2)在含联氨的氨水溶液中,当pH为9.5和10.0时,联氨对20钢起到了较好的缓蚀作用,且随着联氨含量的增加,20钢的腐蚀速率下降。这可能是因为联氨在阳极表面的吸附作用以及联氨的氧化替代反应抑制了20钢的阳极溶解。当pH为10.5和11.0时,20钢的腐蚀速率随联氨含量的增加而增大,联氨促进了20钢的腐蚀,这可归因于其对20钢表面钝化的抑制作用。
(3)确定了20钢耐蚀性能较好的两个氨法停炉保护工艺条件:pH为9.5的含200 mg/L联氨-氨水溶液,及pH为10.5的氨水溶液(不含联氨)。通过调节水溶液的pH至合适范围,可以在不采用联氨条件下对20钢起到较好的保护作用。
文章来源——材料与测试网









 浙公网安备 33042402000106号
浙公网安备 33042402000106号

